В настоящее время клинические испытания во Вьетнаме в основном направлены на разработку новых продуктов, таких как: лекарственные препараты, вакцины, медицинское оборудование, новые методы лечения... В частности, в последние годы проводятся исследования в области клеточной и генной терапии.
Клинические испытания должны быть одобрены и тщательно оценены перед их реализацией, поскольку процесс тестирования, новые продукты и методы могут представлять риск для добровольцев, принимающих участие в исследовании.
Однако на самом деле на протяжении многих лет проводились исследования, одобренные министерствами и ведомствами, отличными от Министерства здравоохранения, для проведения исследований на людях, но не одобренные Советом по этике биомедицинских исследований.
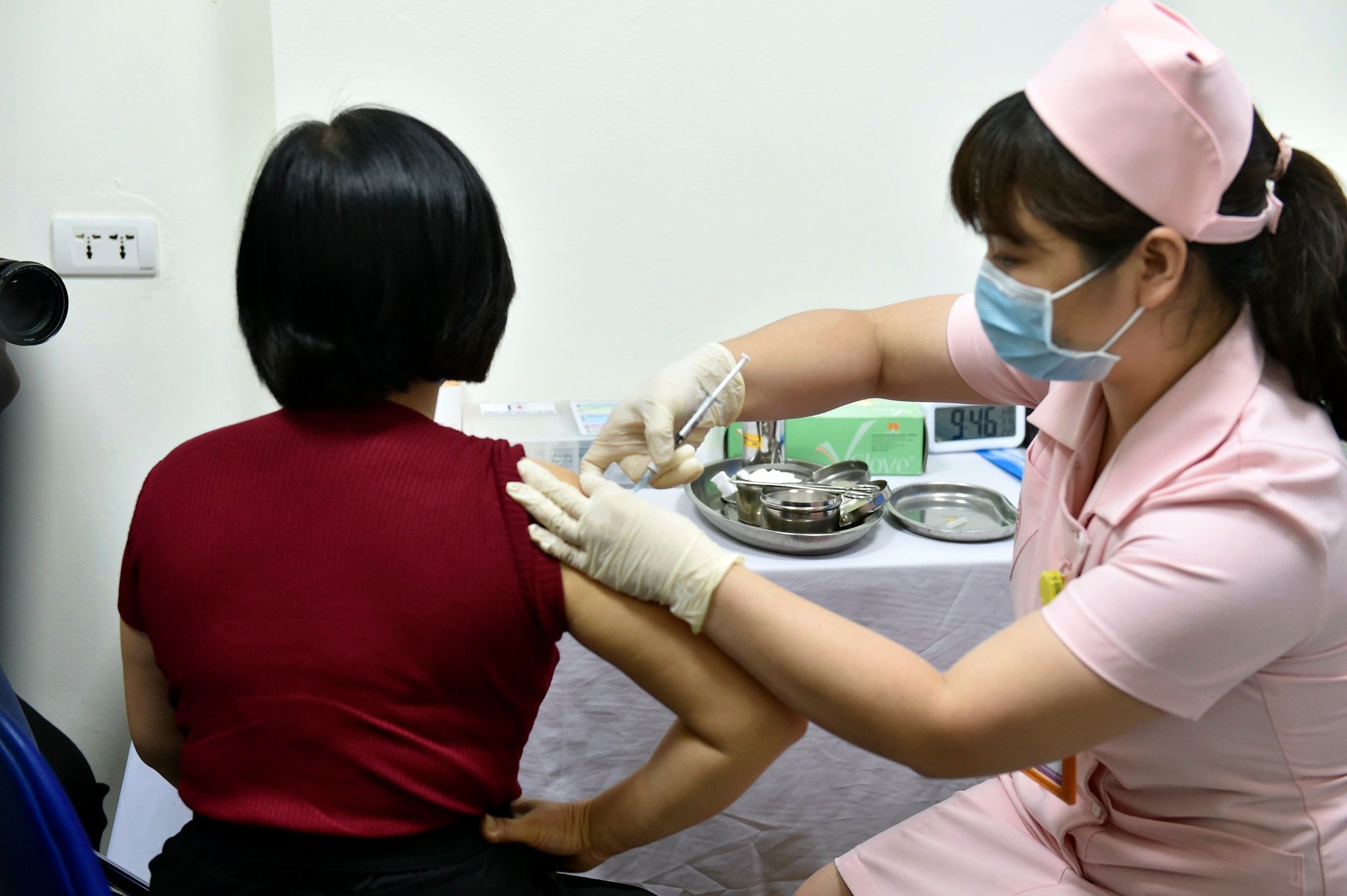
Экспериментальная инъекция вакцины Covivac от COVID-19 в Ханойском медицинском университете, март 2021 г.
Министерство здравоохранения просит представить комментарии к проекту циркуляра, регулирующего управление научными и технологическими задачами, находящимися в ведении Министерства здравоохранения. В проекте предлагается, чтобы исследовательские темы, финансируемые из внебюджетных источников и управляемые другими министерствами и ведомствами, но включающие исследования с участием людей, могли выполняться только после одобрения Советом по этике биомедицинских исследований и утверждения Министерством здравоохранения. В то же время в проекте подчеркивается и продвигается роль местных советов при подразделениях в утверждении планов исследований, сокращении сроков утверждения в Министерстве здравоохранения и обеспечении прогресса в исследованиях.
Во Вьетнаме ежегодно проводится около 100 клинических испытаний, что является благоприятным фактором для страны в плане доступа к новым технологиям, продуктам и методам лечения и здравоохранения, особенно в отношении сложных заболеваний, таких как рак, сердечно-сосудистые заболевания и т. д. После одобрения новых продуктов и методов Вьетнам также станет местом раннего доступа к ним, включая лекарственные препараты, вакцины и т. д. Однако до получения официальной лицензии процесс клинических испытаний может представлять риск для здоровья и жизни добровольцев, поэтому его необходимо строго одобрять и контролировать в ходе реализации.
Согласно действующим нормативным актам, Министерство здравоохранения отвечает за управление, руководство и организацию проведения биомедицинских исследований с участием человека. Научные и технологические задачи, связанные с биомедицинскими исследованиями с участием человека, перед их выполнением организация, ответственная за выполнение, должна получить одобрение Совета по этике в области биомедицинских исследований (в соответствии с положениями циркуляра № 04/2020/TT-BYT).
Ссылка на источник



































































![[Фото] Международное сообщество поздравляет Вьетнам с тем, что ещё больше ландшафтов признаны Всемирным культурным наследием](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/7/13/58ec71f73ae644bfb5bab9c99043bb7d)

































Комментарий (0)