現在、ベトナムにおける臨床試験は、医薬品、ワクチン、医療機器、新しい治療技術などの新製品の開発に役立つ試験がほとんどです。特に近年は細胞治療や遺伝子治療に関する研究が行われています。
臨床試験は、試験プロセス、新製品、新技術が研究に参加するボランティアにリスクをもたらす可能性があるため、実施前に承認され、綿密に評価される必要があります。
しかし、現実には、長年にわたり、 保健省以外の省庁や部門によって人間を対象とした研究の実施が承認されているものの、生物医学研究倫理委員会によって承認されていない研究が行われてきました。
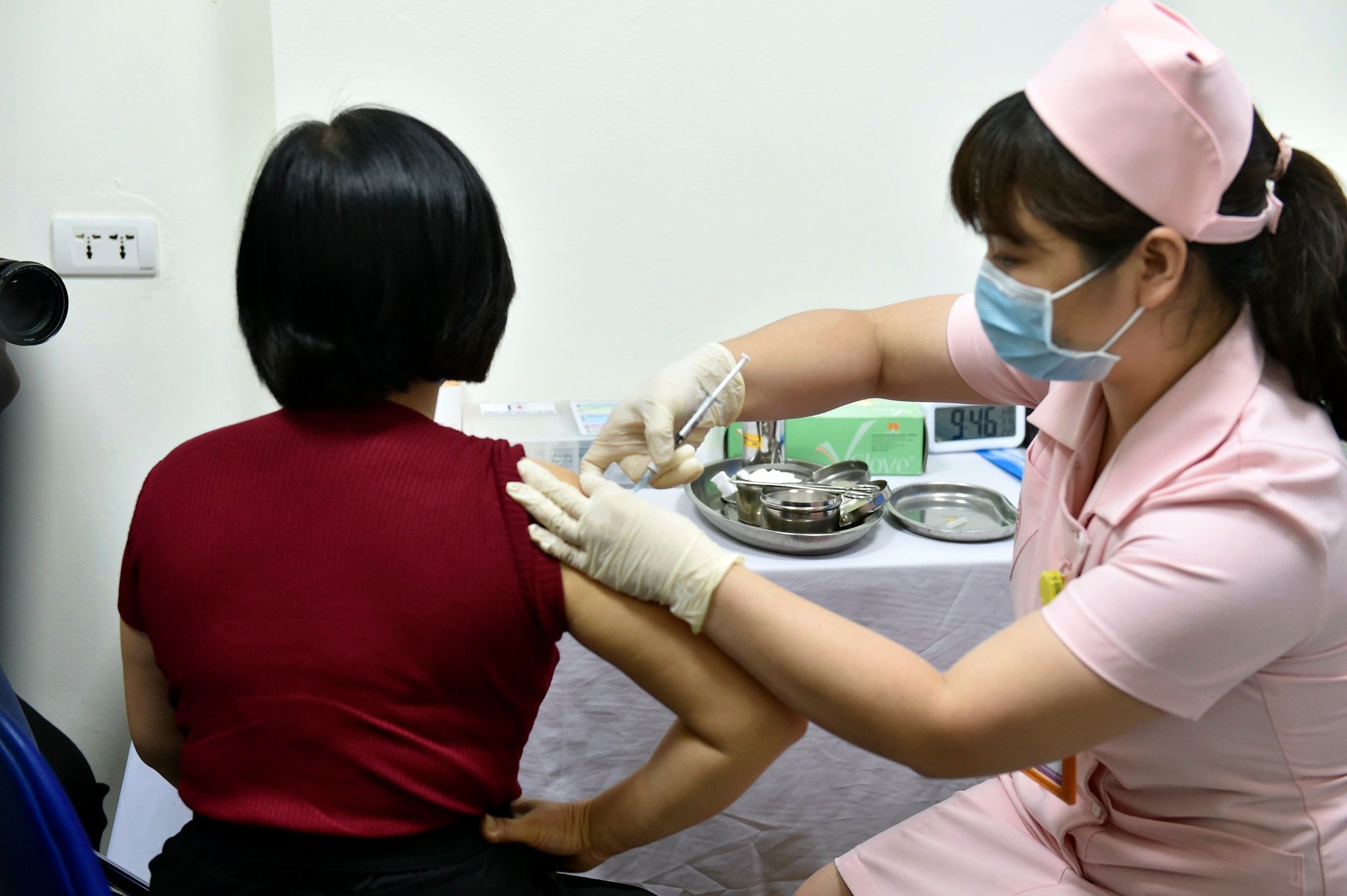
2021年3月、 ハノイ医科大学で行われた新型コロナウイルス感染症ワクチン「コビバック」の実験的接種
保健省は、保健省の管轄下にある科学技術業務の管理を規制する回状草案について意見を募集している。草案では、予算外資金による研究テーマで、他の省庁や部門が管理しているものの、ヒトを対象とした研究は、生物医学研究倫理評議会の承認と保健省の承認を得た場合にのみ実施できると提案されている。同時に、草案は、研究概要の承認における各部署の草の根評議会の役割を強調・促進し、保健省での承認期間を短縮し、研究の進捗を確保することを目指している。
ベトナムでは、毎年約100件の臨床試験が行われており、これは、特にがんや心血管疾患などの難病の治療とヘルスケアにおける新しい技術、製品、方法にアクセスする上で、同国にとって有利な要因となっています。新しい製品や技術が承認されると、ベトナムは医薬品、ワクチンなど、それらに早期にアクセスできる場所にもなります。ただし、正式に認可される前に、臨床試験のプロセスはボランティアの健康や生命にリスクをもたらす可能性があるため、実施中に厳格な承認と監視を受ける必要があります。
現行の規定に基づき、保健省はヒトを対象とする生物医学研究の実施に関する管理、指導、組織化の責任を負っています。ヒトを対象とする生物医学研究に関連する科学技術業務を実施する場合、当該業務を担当する組織は、実施前に生物医学研究倫理委員会の承認を得る必要があります(回状第04/2020/TT-BYT号の規定に基づく)。
[広告2]
ソースリンク



































































































コメント (0)