Recherche et développement d'applications
La conférence sur les solutions et les orientations de développement pour la recherche et l'application de la thérapie cellulaire et des produits cellulaires au Vietnam a été organisée par le ministère de la Santé aujourd'hui, 6 décembre, à Hanoi.
Lors de la conférence, le Dr Nguyen Ngo Quang, directeur adjoint du Département des sciences, de la technologie et de la formation (ministère de la Santé ), a déclaré qu'au Vietnam, la thérapie cellulaire, en particulier la thérapie par cellules souches, est encore spontanée et que de nombreux établissements médicaux ne l'appliquent pas conformément à la réglementation. En particulier, de nombreuses publicités ne sont pas scientifiquement vérifiées, ce qui peut avoir des conséquences pour les patients ou une efficacité incertaine, entraînant des coûts.

Le Dr Nguyen Ngo Quang a affirmé que l'application de la thérapie cellulaire et des produits cellulaires est strictement gérée mais encourage toujours la recherche.
« De nombreux Vietnamiens se sont rendus dans les pays voisins pour dépenser des sommes importantes en thérapie par cellules souches. On entend aussi beaucoup demander : "Les autres pays traitent la thérapie par cellules souches librement, mais pourquoi le ministère de la Santé est-il si strictement réglementé ?" », a expliqué M. Quang.
En réponse à la question ci-dessus, le directeur adjoint du Département des sciences, de la technologie et de la formation a déclaré : « Nous sommes allés dans des pays, avons travaillé avec des agences de gestion et avons appris que les pays gèrent de manière très stricte, en garantissant des principes scientifiques, et non pas librement comme beaucoup de gens le comprennent. »
Des pays comme le Japon, les États-Unis et l'Europe considèrent tous la thérapie cellulaire comme risquée pour l'homme et classent ses niveaux de risque. Les organismes de réglementation stipulent tous qu'il s'agit d'une nouvelle méthode, d'une nouvelle technique, et qu'elle doit être examinée et évaluée par le Conseil d'éthique de la recherche biomédicale afin de définir les exigences de recherche.
Le processus de recherche doit faire l'objet d'une évaluation de sa sécurité et de son efficacité. Une fois appliqué, il doit encore être évalué après la demande, afin que l'organisme de gestion puisse envisager d'autoriser la poursuite de sa mise en œuvre ou de l'interrompre.
« Nous sommes particulièrement intéressés par le produit final de la technologie cellulaire, en termes de sécurité et d'efficacité », a souligné M. Quang.
Le gouvernement confie au ministère de la Santé la supervision de la recherche biomédicale sur les êtres humains, garantissant ainsi le respect des droits de l’homme.
Le ministère de la Santé est en train de finaliser le système de documents juridiques pour compléter la réglementation sur la recherche, les essais cliniques et l'application des thérapies cellulaires dans le traitement et les soins de santé pour les personnes.
La réglementation doit garantir le principe d’encouragement du développement scientifique et technologique dans les soins de santé des personnes, mais pas de manière spontanée, et doit être sûre et efficace.
Les nouvelles technologies sont utilisées pour aider les gens à avoir une meilleure santé, plus efficacement, mais elles nécessitent un cadre juridique, notamment des preuves scientifiques et une efficacité.
Cellules souches : médicament ou procédé technique ?
Fort de nombreuses années d'expérience dans la recherche sur la technologie cellulaire et l'immunothérapie cellulaire, le professeur Ta Thanh Van, responsable du programme KC regroupant 10 pays, a déclaré que les pays se disputent encore au sujet des cellules souches, car les applications thérapeutiques actuelles ont des effets différents.

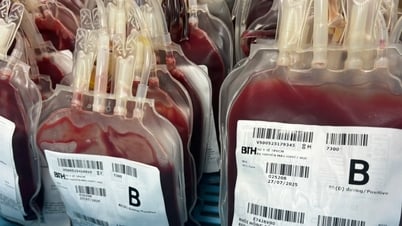
Transfusion de cellules souches pour traiter les maladies du sang à l'Institut national d'hématologie et de transfusion sanguine
La raison est que nous traitons des individus et que l'efficacité du traitement dépend de la qualité des cellules de chaque individu. À l'exception de la greffe de cellules souches dans le traitement des maladies du sang, dont les effets sont évidents.
Cette réalité montre la nécessité d’une réglementation juridique sur la thérapie cellulaire afin de ne pas entraver le développement mais aussi de ne pas en abuser et de provoquer du gaspillage.
En particulier, le professeur Van a déclaré qu'il est nécessaire de clarifier si « les cellules souches sont un produit ou un processus technique » pour la gestion dans le processus d'application du traitement et des soins de santé.
Les cellules souches ne sont pas des médicaments, mais le procédé technique non plus. En effet, dans une certaine mesure, les cellules souches sont des médicaments lorsqu'elles créent des produits cellulaires qui sont ensuite injectés dans la même espèce.
Dans le cas de l’isolement de cellules souches humaines pour les injecter dans ce même individu, c’est le processus.
Face à la distinction floue entre médicaments et procédés techniques en thérapie cellulaire, notamment pour les applications à base de cellules souches, le professeur Ta Thanh Van a souligné la nécessité d'inspecter les préparations de cellules souches. Le ministère de la Santé doit définir des critères de qualité pour les blocs cellulaires et les cellules souches, et mettre en place des laboratoires de référence et des inspections externes.
Les unités de production cellulaire doivent d’abord déclarer la qualité, sur la base de normes émises par le ministère de la Santé.
Lien source



![[Photo] Le rouge éclatant de l'exposition 95 ans du Drapeau du Parti éclaire le chemin avant le vernissage](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/8/27/e19d957d17f649648ca14ce6cc4d8dd4)


![[Photo] Le Premier ministre Pham Minh Chinh reçoit le PDG de Samsung Electronics](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/8/26/373f5db99f704e6eb1321c787485c3c2)
![[Photo] Le Premier ministre Pham Minh Chinh préside la réunion du Comité directeur national sur l'intégration internationale](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/8/26/9d34a506f9fb42ac90a48179fc89abb3)





























![[Photo] Le secrétaire général To Lam assiste à une réunion avec des générations de députés de l'Assemblée nationale](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/8/27/d869c6b3e4da42399e2cd0f4ca26050c)





























































Comment (0)