Actualmente, los ensayos clínicos en Vietnam son en su mayoría ensayos que sirven para el desarrollo de nuevos productos como: medicamentos, vacunas, equipos médicos , nuevas técnicas de tratamiento... En particular, en los últimos años se han realizado estudios sobre terapia celular y genética.
Los ensayos clínicos deben ser aprobados y evaluados cuidadosamente antes de su implementación porque el proceso de prueba, los nuevos productos y las técnicas pueden representar riesgos para los voluntarios que participan en la investigación.
Sin embargo, en la realidad, a lo largo de los años ha habido estudios aprobados por ministerios y sectores distintos al Ministerio de Salud para realizar investigaciones en humanos pero no aprobados por el Consejo de Ética en Investigación Biomédica.
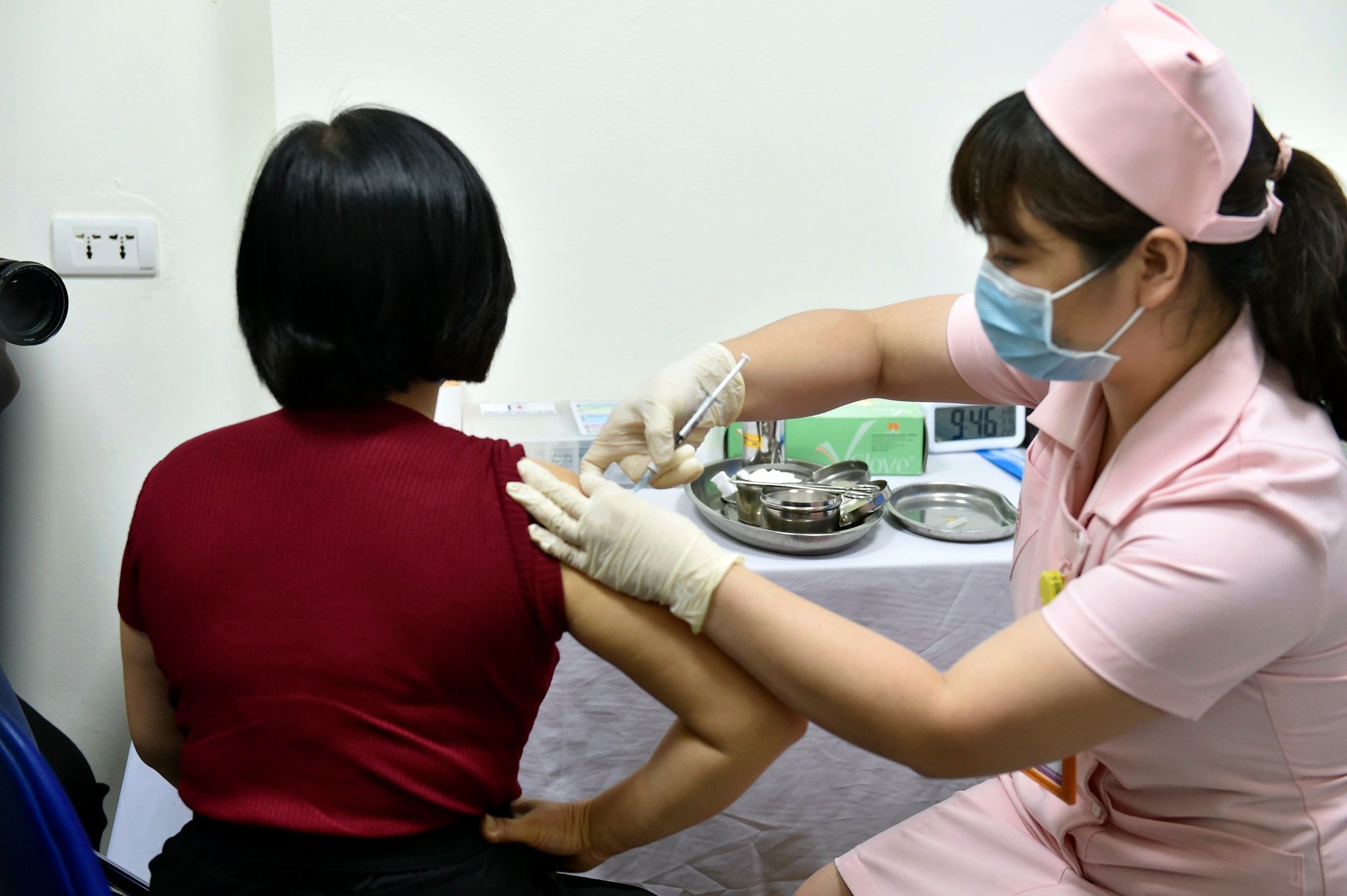
Inyección experimental de la vacuna contra la COVID-19 Covivac en la Universidad Médica de Hanói , marzo de 2021
El Ministerio de Salud solicita comentarios sobre un proyecto de circular que regula la gestión de las tareas científicas y tecnológicas bajo su responsabilidad. El proyecto propone que las investigaciones financiadas con recursos no presupuestarios, gestionadas por otros ministerios y sectores, pero que impliquen investigación en seres humanos, solo puedan llevarse a cabo tras la aprobación del Consejo de Ética de la Investigación Biomédica y del Ministerio de Salud. Asimismo, el proyecto enfatiza y promueve el papel de los consejos de base en las unidades en la aprobación de los esquemas de investigación, lo que reduce el plazo de aprobación en el Ministerio de Salud y garantiza el progreso de la investigación.
En Vietnam, se realizan alrededor de 100 ensayos clínicos al año, lo que facilita el acceso al país a nuevas tecnologías, productos y métodos de tratamiento y atención médica, especialmente para enfermedades complejas como el cáncer y las enfermedades cardiovasculares. Cuando se aprueben nuevos productos y técnicas, Vietnam también será el lugar de acceso temprano a ellos, incluyendo medicamentos, vacunas, etc. Sin embargo, antes de obtener la licencia oficial, el proceso de ensayos clínicos puede representar riesgos para la salud y la vida de los voluntarios, por lo que es necesario contar con una estricta aprobación y supervisión durante su implementación.
De acuerdo con la normativa vigente, el Ministerio de Salud es responsable de gestionar, guiar y organizar la implementación de la investigación biomédica en seres humanos. Antes de implementar las tareas científicas y tecnológicas relacionadas con la investigación biomédica en seres humanos, la organización encargada debe contar con la aprobación del Consejo de Ética en Investigación Biomédica (según lo dispuesto en la Circular n.º 04/2020/TT-BYT).
[anuncio_2]
Enlace de origen




















































![[Noticias Marítimas] Más del 80% de la capacidad mundial de transporte de contenedores está en manos de MSC y las principales alianzas navieras.](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/7/16/6b4d586c984b4cbf8c5680352b9eaeb0)












































Kommentar (0)