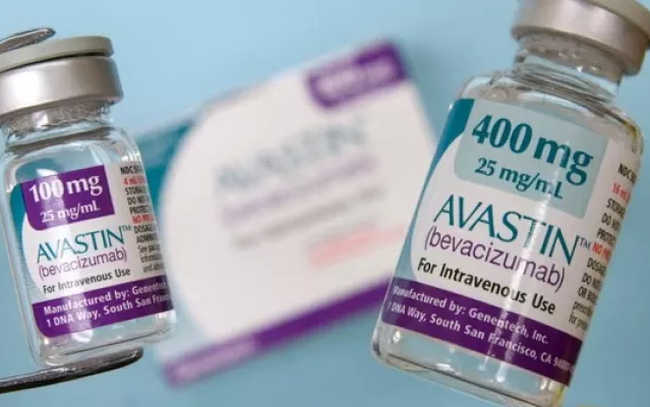
Pakistán investiga a dos distribuidores de Avastin, un medicamento contra el cáncer de Roche, después de que 12 pacientes diabéticos quedaran ciegos tras recibir inyecciones del fármaco. Avastin también está autorizado en Vietnam.
En Vietnam, hasta el 27 de septiembre, la Administración de Medicamentos de Vietnam ( Ministerio de Salud ) no ha recibido ningún informe que refleje efectos no deseados de Avastin relacionados con la pérdida de visión de los pacientes después de usar Avastin.
La Administración de Medicamentos de Vietnam recibió un informe de la Oficina de Representación de F. Hoffmann La Roche Ltd. sobre el incidente.
En Pakistán, aproximadamente 12 pacientes perdieron la visión tras usar inyecciones suministradas por el proveedor ilegal Genius Pharmaceutical Service. El medicamento estaba etiquetado como "Iny. Avastin 1,25 mg/0,05 ml", lo que generó la falsa impresión de que se trataba de un producto de Roche.
Avastin de Roche no está aprobado para ningún uso oftálmico. Genius Pharmaceutical Service suministró, diluyó y reenvasó la dosis de 1,25 mg/0,5 ml en condiciones insalubres y no autorizadas.
Las autoridades pakistaníes están investigando la causa de la contaminación. Entre las posibles causas se incluyen la esterilización inadecuada, viales contaminados, jeringas sin esterilizar y la violación de los procedimientos operativos estándar durante la dispensación de medicamentos.
Al mismo tiempo, el gobierno paquistaní ha solicitado la retirada de tres lotes de Avastin 100 mg/ml (H352B11, B7266B07, B7266B20) de Roche y de todos los medicamentos suministrados por Genius Pharmaceutical Service.
(Ilustración: 24 News HD).
En Vietnam, Avastin (principio activo: bevacizumab) ha obtenido cuatro certificados de registro de circulación, todos ellos vigentes. Entre ellos:
Bevacizumab 100 mg/4 ml (caja de 1 vial x 4 ml; número de registro: 400410250123 (QLSP-1118- 18); fabricante: Roche Diagnostics GmbH, Alemania).
Bevacizumab 400 mg/16 ml (caja de 1 vial x 16 ml: número de registro: 400410250223 (QLSP-1119- 18); fabricante: Roche Diagnostics GmbH, Alemania).
Bevacizumab 100 mg/4 ml (caja de 1 vial x 16 ml; número de registro: QLSP-1010-17; fabricante: F. Hoffmann-La Roche Ltd., Suiza).
Bevacizumab 400 mg/16 ml (Caja de 1 vial x 16 ml; número de registro: QLSP-1011-17; fabricante: F. Hoffmann-La Roche Ltd., Suiza).
Avastin está autorizado en Vietnam para el tratamiento de ciertos tipos de cáncer, entre ellos, cáncer colorrectal metastásico, cáncer de pulmón de células no pequeñas avanzado, metastásico o recurrente, carcinoma de células renales avanzado y/o metastásico, glioblastoma/glioma maligno (estadio IV de la OMS); cáncer epitelial de ovario, de trompas de Falopio y cáncer peritoneal primario.
Además de las advertencias generales, el prospecto aprobado por la FDA incluye una advertencia que indica "no apto para uso intravítreo".
En concreto, el medicamento puede producir alteraciones visuales y se han notificado casos individuales y grupos de acontecimientos adversos oculares graves tras la inyección intravítrea, una vía de administración no aprobada con mezclas de Avastin procedentes de viales destinados a la infusión intravenosa en pacientes con cáncer.
Estas reacciones incluyen infección intraocular, endoftalmitis, uveítis, desprendimiento de retina, desgarro del epitelio pigmentario de la retina, glaucoma, hemorragia intraocular… Algunos de estos eventos han resultado en diversos grados de pérdida del campo visual, incluida ceguera permanente .
[anuncio_2]
Fuente



















































![[Noticias Marítimas] Más del 80% de la capacidad mundial de transporte de contenedores está en manos de MSC y las principales alianzas navieras.](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/7/16/6b4d586c984b4cbf8c5680352b9eaeb0)












































Kommentar (0)