تُجري باكستان تحقيقًا مع اثنين من موزعي دواء أفاستين لعلاج السرطان، الذي تنتجه شركة روش، بعد إصابة 12 مريضًا بالسكري بالعمى بعد تلقيهم حقنًا من الدواء. يُذكر أن أفاستين مُرخص أيضًا في فيتنام.
وفي فيتنام، حتى 27 سبتمبر/أيلول، لم تتلق إدارة الأدوية في فيتنام ( وزارة الصحة ) أي تقارير تعكس التأثيرات غير المرغوب فيها لدواء أفاستين فيما يتعلق بفقدان المرضى للبصر بعد استخدام أفاستين.
تلقت إدارة الأدوية في فيتنام تقريراً من المكتب التمثيلي لشركة F. Hoffmann La Roche Ltd. بشأن الحادث.
على وجه التحديد، في باكستان، فقد حوالي 12 مريضًا بصرهم بعد استخدام حقن من مورد غير قانوني، وهو شركة جينيوس للأدوية. كان الدواء يحمل علامة "حقنة أفاستين 1.25 ملغ/0.05 مل"، مما أدى إلى الاعتقاد الخاطئ بأنه منتج من شركة روش.
دواء أفاستين من شركة روش غير معتمد للاستخدام في طب العيون. قامت شركة جينيوس للخدمات الصيدلانية بتوريد/تخفيف/إعادة تعبئة جرعة 1.25 ملجم/0.5 مل في ظروف غير صحية وغير معتمدة.
تُجري السلطات الباكستانية تحقيقًا لمعرفة سبب التلوث. ومن الأسباب المحتملة عدم كفاية التعقيم، وتلوث القوارير، وعدم تعقيم الحقن، والانحراف عن إجراءات التشغيل القياسية أثناء صرف الأدوية.
وفي الوقت نفسه، طلبت الحكومة الباكستانية سحب 3 دفعات من عقار أفاستين 100 ملغ/مل (H352B11، B7266B07، B7266B20) من شركة روش وجميع الأدوية التي توفرها شركة جينيوس للأدوية.
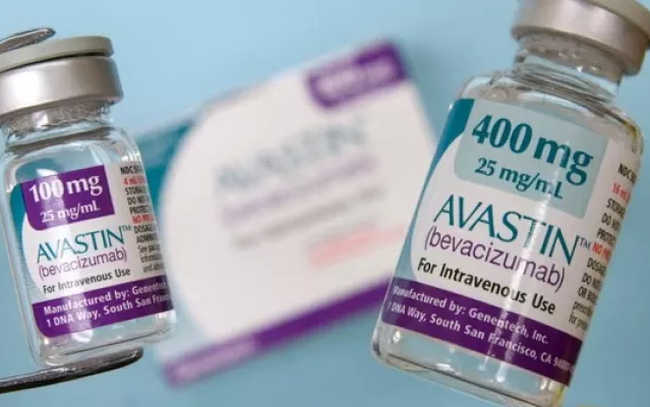
(صورة توضيحية: 24 News HD).
في فيتنام، مُنح دواء أفاستين (المكون النشط بيفاسيزوماب) أربع شهادات تسجيل تداول، وجميعها لا تزال سارية المفعول. وتشمل هذه الشهادات:
بيفاسيزوماب 100 ملجم/4 مل (علبة تحتوي على قارورة واحدة × 4 مل؛ رقم التسجيل: 400410250123 (QLSP-1118- 18)؛ الشركة المصنعة: Roche Diagnostics GmbH، ألمانيا).
بيفاسيزوماب 400 ملجم/16 مل (علبة تحتوي على قارورة واحدة × 16 مل: رقم التسجيل: 400410250223 (QLSP-1119- 18)؛ الشركة المصنعة: Roche Diagnostics GmbH، ألمانيا).
بيفاسيزوماب 100 ملجم/4 مل (علبة تحتوي على قارورة واحدة × 16 مل؛ رقم التسجيل: QLSP-1010-17؛ الشركة المصنعة: F. Hoffmann-La Roche Ltd.، سويسرا).
بيفاسيزوماب 400 ملجم/16 مل (علبة تحتوي على قارورة واحدة × 16 مل؛ رقم التسجيل: QLSP-1011-17؛ الشركة المصنعة: F. Hoffmann-La Roche Ltd.، سويسرا).
تم ترخيص أفاستين في فيتنام لعلاج بعض أنواع السرطان، بما في ذلك سرطان القولون والمستقيم النقيلي، وسرطان الرئة غير صغير الخلايا المتقدم أو النقيلي أو المتكرر، وسرطان الخلايا الكلوية المتقدم و/أو النقيلي، وورم أرومي دبقي/ورم دبقي خبيث (المرحلة الرابعة حسب تصنيف منظمة الصحة العالمية)؛ وسرطان المبيض الظهاري، وسرطان قناة فالوب، وسرطان الصفاق الأولي.
بالإضافة إلى التحذيرات العامة، تتضمن النشرة الداخلية المعتمدة من إدارة الغذاء والدواء تحذيرًا بشأن "عدم الاستخدام داخل الجسم الزجاجي".
وعلى وجه التحديد، قد يسبب الدواء اضطرابات بصرية، وتم الإبلاغ عن حالات فردية ومجموعات من الأحداث السلبية الخطيرة في العين بعد الحقن داخل الجسم الزجاجي، وهو طريق غير معتمد للإعطاء باستخدام مخاليط أفاستين من قوارير مخصصة للتسريب الوريدي لمرضى السرطان.
تشمل هذه التفاعلات العدوى داخل العين، والتهاب باطن العين، والتهاب العنبية، وانفصال الشبكية، وتمزق الظهارة الصبغية الشبكية، والزرق، والنزيف داخل العين... وقد أدت بعض هذه الأحداث إلى درجات متفاوتة من فقدان المجال البصري، بما في ذلك العمى الدائم .
[إعلان 2]
مصدر




































































































تعليق (0)