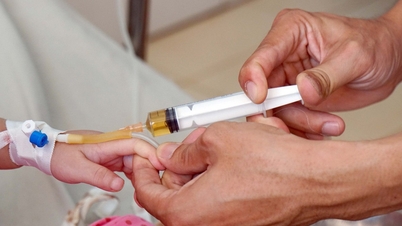
Dr. Nguyen Van Loi, Kepala Departemen Registrasi Obat (Departemen Administrasi Obat - Kementerian Kesehatan ) mengatakan: Setelah lebih dari 7 tahun penerapan Undang-Undang Farmasi 2016, di samping hasil yang dicapai, beberapa peraturan terkait registrasi peredaran obat dan bahan obat telah mengungkapkan kekurangan yang perlu disesuaikan.
Terkait berkas, tata cara dan prosedur perpanjangan masa berlaku Surat Tanda Registrasi Edar untuk obat dan bahan farmasi, diatur bahwa semua berkas perpanjangan Surat Tanda Registrasi Edar harus melalui proses penilaian dan persetujuan Dewan Pertimbangan pemberian Surat Tanda Registrasi Edar. Ketentuan Undang-Undang Farmasi Tahun 2016 ini telah memberikan kontribusi dalam menjamin mutu, keamanan, dan khasiat obat selama dalam peredaran. Namun, untuk obat yang selama dalam masa peredaran di pasaran tidak mendapat umpan balik terkait mutu, keamanan bagi pengguna atau tidak memiliki rekomendasi dari Badan Kesehatan Dunia (WHO) tetapi tetap harus melalui Dewan Pertimbangan, hal ini tidak diperlukan, dapat menambah waktu pemrosesan, sehingga menimbulkan beban berlebih bagi Dewan Pertimbangan.
Oleh karena itu, perlu dibedakan berkas perpanjangan Tanda Registrasi Edar yang wajib dan tidak wajib dikaji dan disetujui oleh Dewan Pertimbangan Pemberian Tanda Registrasi Edar, agar peredaran obat dan bahan farmasi tetap lancar dan aman, serta terjamin keamanan dan khasiatnya bagi pengguna.
Di sisi lain, peraturan tentang berkas untuk memperpanjang masa berlaku Sertifikat Registrasi Edar mewajibkan penyerahan enam jenis dokumen, terutama dokumen administratif. Keharusan menyerahkan banyak dokumen dalam berkas telah menyebabkan pemborosan waktu dan sumber daya bagi pelaku usaha dalam menyiapkan berkas, serta menciptakan tekanan bagi badan pengelola untuk menilai dan menyetujui berkas. Saat ini, Kementerian Kesehatan telah menerapkan sistem perizinan daring dan dalam waktu dekat akan menghubungkannya dengan basis data farmasi nasional, sehingga dokumen-dokumen ini dapat dicari secara lengkap, sehingga tidak perlu mengajukan permohonan ulang.
Perubahan dan penambahan Sertifikat Laik Edar Obat dan Bahan Farmasi harus disetujui melalui penilaian berkas dan konsultasi Dewan Pertimbangan Penerbitan Sertifikat Laik Edar Obat dan Bahan Farmasi. Namun, pada kenyataannya, peraturan ini tidak diperlukan, sehingga membuang-buang waktu bagi pelaku usaha dan sekaligus menambah beban waktu pengurusan prosedur administrasi bagi instansi pemerintah dalam hal perubahan administrasi sederhana (perubahan alamat surat menyurat, perubahan penulisan nama, alamat pabrik, registrasi obat, penambahan kode QR, dll.) karena perubahan dan penambahan ini tidak berkaitan dengan keahlian teknis, keamanan, dan efektivitas obat.
Peraturan tentang uji klinis obat-obatan saat pendaftaran peredaran obat herbal dengan kombinasi baru tanaman obat yang selama ini digunakan sebagai obat di Vietnam juga tidak sesuai dan tidak sepenuhnya konsisten dengan mekanisme manajemen obat baru saat ini di Vietnam dan negara-negara lain di kawasan tersebut.
 |
Menteri Kesehatan Dao Hong Lan melaporkan, menjelaskan, menerima dan mengklarifikasi sejumlah masalah Undang-Undang yang mengubah dan melengkapi sejumlah pasal Undang-Undang tentang Farmasi pada pertemuan pada sore hari tanggal 26 Juni. |
Berdasarkan kekurangan tersebut, Rancangan Undang-Undang Perubahan dan Penambahan beberapa pasal dalam Undang-Undang Farmasi telah melakukan penyesuaian ke arah penyederhanaan berkas perpanjangan, perubahan, dan penambahan Tanda Registrasi Edar obat dan bahan farmasi; pengaturan perkara perpanjangan, perubahan, dan penambahan Tanda Registrasi Edar tanpa harus melalui Dewan Pertimbangan pemberian Tanda Registrasi Edar maupun tanpa harus menunggu persetujuan Kementerian Kesehatan untuk menyederhanakan prosedur administratif. Khususnya, pengurangan waktu pengurusan berkas perubahan dan penambahan yang hanya perlu diumumkan dari 3 bulan menjadi 15 hari kerja; penambahan ketentuan yang memperbolehkan tempat usaha untuk tetap menggunakan Tanda Registrasi Edar setelah habis masa berlakunya dan telah menyampaikan berkas perpanjangan sesuai ketentuan sampai dengan dilakukan perpanjangan atau memperoleh dokumen dari Kementerian Kesehatan.
Mengizinkan penggantian Sertifikat Produk Farmasi (SKP) dengan dokumen yang membuktikan bahwa obat tersebut telah memiliki izin edar apabila memenuhi kebutuhan pencegahan dan pengendalian penyakit; membebaskan kewajiban penyampaian rekam medis dalam permohonan Surat Tanda Registrasi Edar (STR) untuk obat baru (kecuali vaksin) produksi dalam negeri yang memiliki indikasi penggunaan untuk pencegahan dan pengobatan penyakit golongan A yang telah ditetapkan sebagai wabah sesuai ketentuan peraturan perundang-undangan di bidang pencegahan dan pengendalian penyakit menular serta mempunyai zat aktif, bentuk sediaan, cara pemberian, dan indikasi yang sama dengan obat yang telah memiliki izin edar atau izin penggunaan dalam keadaan darurat atau izin edar dan penggunaan dengan syarat-syarat dari Badan Pengawas Obat dan Makanan (BPOM).
Mengenai batas waktu pemberian Surat Keterangan Registrasi Edar pada kasus referensi, paling lama 09 (sembilan) bulan terhitung sejak tanggal diterimanya berkas lengkap obat baru, produk biologi referensi, produk biologi sejenis, dan vaksin beserta laporan hasil uji dari Badan Pengawas Obat dan Makanan (BPOM) sesuai dengan ketentuan Menteri Kesehatan.
Dalam waktu 10 hari kerja sejak tanggal penerimaan berkas lengkap, Kementerian Kesehatan akan menilai berkas administratif untuk menerbitkan Sertifikat Registrasi Sirkulasi berdasarkan pengakuan hasil perizinan dari badan administrasi obat ketat (SRA) untuk berkas registrasi obat baru dengan indikasi untuk digunakan dalam pencegahan dan pengobatan penyakit kelompok A yang telah dinyatakan epidemi sesuai dengan ketentuan undang-undang tentang pencegahan dan pengendalian penyakit menular; menugaskan fasilitas registrasi obat untuk bertanggung jawab atas keakuratan dan legalitas berkas teknis dan berkas penilaian kepatuhan dengan Cara Pembuatan Obat yang Baik untuk fasilitas pembuatan obat. Kementerian Kesehatan akan memeriksa dan mengevaluasi keahlian teknis dari berkas teknis dan berkas penilaian kepatuhan dengan Cara Pembuatan Obat yang Baik untuk fasilitas pembuatan obat setelah menerbitkan Sertifikat Registrasi Sirkulasi.
Obat dan bahan farmasi yang telah memiliki Surat Tanda Registrasi Edar (STR) tetapi tidak diedarkan di pasaran dalam jangka waktu 5 (lima) tahun sejak tanggal penerbitan, tidak dapat diperpanjang STR-nya, kecuali obat langka, obat untuk pengobatan penyakit langka, atau obat yang Surat Tanda Registrasi Edarnya masih berlaku paling banyak 3 (tiga) kali.
Hapuskan regulasi tentang uji klinis obat-obatan herbal dengan kombinasi baru obat-obatan herbal yang telah digunakan sebagai obat di Vietnam dan diindikasikan untuk penyakit pada daftar yang dikeluarkan oleh Menteri Kesehatan.
[iklan_2]
Sumber: https://nhandan.vn/sua-doi-nhieu-chinh-sach-ve-dang-ky-luu-hanh-thuoc-nguyen-lieu-lam-thuoc-post816365.html































![[Foto] Presiden Luong Cuong bertemu dengan Presiden Rusia Vladimir Putin](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/9/3/87982dff3a724aa880eeca77d17eff7f)




























![[VIDEO] Petrovietnam – 50 Tahun Menjaga Obor Warisan, Membangun Energi Nasional](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/9/3/3f5df73a4d394f2484f016fda7725e10)





































Komentar (0)